Madre no hay más que una. Pero desde que este pasado martes el parlamento británico diera luz verde a una nueva técnica de fecundación in vitro, la que permite generar «bebés de tres padres», tendremos que añadir una excepción a la frase hecha. Al menos desde el punto de vista de los genes.
El asunto tiene su miga. El problema es que existe una amplia variedad de enfermedades raras relacionadas con daños en las mitocondrias, unos componentes de las células humanas que funcionan como fábricas de energía y que los seres humanos heredamos de nuestras madres, cuando apenas tenemos la complejidad de un zigoto. Pues bien, una nueva técnica le puede permitir a las madres portadoras de mitocondrias defectuosas tener hijos sin estos defectos, básicamente usando las mitocondrias de otras mujeres. Hasta ahí no hay ningún problema. Pero esta técnica experimental puede implicar la manipulación de embriones humanos y esto tendría muchas implicaciones éticas. ¿Es una forma de darle esperanza a las familias aquejadas de estas enfermedades mitocondriales? ¿O es un paso más en la dirección de los bebés a la carta?
Con la intención de comprender un poco mejor esta técnica y cómo se hacen habitualmente las fecundaciones in vitro, y sin entrar en los espinosos aspectos éticos, hablé con Muriel Cuadros, licenciada en Biología y embrióloga clínica que trabaja a diario en este campo. Sin más, os dejo con ella:
-¿Cómo se lleva a cabo esta nueva técnica?
El procedimiento se puede realizar de dos formas:
1) Transfiriendo el núcleo de un oocito inmaduro de la mujer afectada al citoplasma de un oocito de una donante sana al que previamente se le ha extraído el núcleo.
2) Primero se fecundan los oocitos tanto de la paciente como de la donante, y lo que se extrae son los pronúcleos paterno y materno del oocito fecundado de la paciente, que luego se transfieren al citoplasma del oocito fecundado de la donante, al que se le han extraído previamente sus propios pronúcleos.
-Entonces, ¿cuál es el proceso habitual de fecundación in vitro?
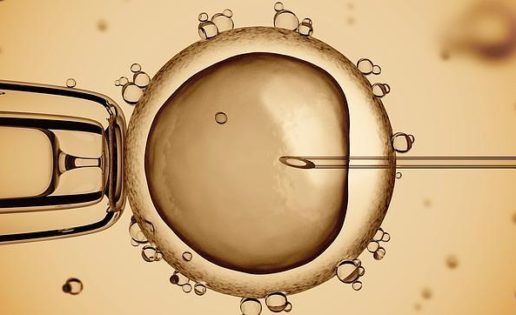
En las técnicas de reproducción asistida existen básicamente dos procedimientos para llevar a cabo la fecundación dentro de un laboratorio. El primero es la fecundación in vitro clásica (FIV), en la que se sitúa una muestra de espermatozoides en un medio liquido donde también se encuentran los oocitos, y sin más intervención un espermatozoide tiene que entrar dentro de cada oocito para que ocurra la fecundación. El segundo es la inyección intracitoplasmática de espermatozoides (ICSI), que consiste en introducir un espermatozoide en cada oocito mecánicamente, de forma que hacemos una selección morfológica de los espermatozoides y además les ayudamos a cruzar una barrera más, obteniendo unas tasas de fecundación muy elevadas.
-¿Así que esta nueva técnica es muy distinta de la habitual?
Es radicalmente distinta, y de momento experimental. En los procedimientos que realizamos actualmente en los laboratorios de reproducción asistida no se produce la modificación de ningún gameto. Se seleccionan, se cultivan, se realizan análisis morfológicos e incluso genéticos, pero nunca modificaciones.
-¿Qué problemas plantea?
Como técnica es, obviamente, espectacular, pero sigue siendo una técnica experimental. Mi gran crítica es a la forma en la que se ha dado a conocer y a algunos de los argumentos utilizados. Por una parte se dice que la técnica es segura y lo cierto es que eso no se podrá afirmar con certeza hasta que haya nacido un número considerable de niños completamente sanos. Por otra parte, experimentar con esto supone asumir unos riesgos enormes y éticamente complejos. Estamos hablando de experimentar con embriones humanos.
-¿Hay alternativas?
Existen tratamientos que permiten que estas parejas tengan hijos sanos. Uno de ellos es la donación de óvulos, que realizamos en la clínica de forma rutinaria y con tasas de éxito extraordinarias.
La diferencia aquí está en el deseo de los padres de tener hijos que hereden sus genes. A esto se enfrentan diariamente el alto porcentaje de parejas que necesitan usar gametos de donante, ya sean óvulos o espermatozoides, y el resultado, cuando lo aceptan, es que tienen niños sanos e igualmente queridos y deseados que el resto de niños que comparten genes con sus progenitores, y que sin duda heredarán todos esos rasgos que todos tenemos de nuestros padres que no provienen de la herencia genética.
Como opinión personal, me sorprende que haya pacientes que se quieran someter a un tratamiento experimental de este nivel y asumir todos esos riesgos no para tener hijos sanos, sino para preservar su genética. Creo que no se ha valorado correctamente el impacto que esto puede tener tanto en los pacientes que sufren enfermedades que se transmiten por herencia mitocondrial, a los que habrán ilusionado sin tener todavía garantías de eficacia, y mucho menos se ha pensado en todos los pacientes que se someten a tratamientos de reproducción asistida, con la carga psicológica que eso supone. Hoy mismo ya hemos tenido consultas de pacientes preguntando si esta técnica podría ayudarles en su tratamiento.
-¿Se puede decir que el bebé tiene genes procedentes de tres progenitores o esto es un poco tramposo?
Es un poco tramposo, porque los genes mitocondriales son importantes para la fisiología de la célula, pero no tienen nada que ver con lo que la gente suele entender por “herencia genética”. Por eso el niño resultante no tendría ningún “parecido” con la donante del oocito. Resulta confuso para mucha gente el hecho de distinguir entre genes mitocondriales y genes procedentes del núcleo, que son de los que habitualmente se habla cuando nos referimos a la herencia genética, pero técnicamente sí tendría genes de tres progenitores distintos.
-¿Es muy determinante usar mitocondrias de un tercer progenitor para el desarrollo?
Unas mitocondrias “sanas” son indispensables para el desarrollo correcto del embrión y el niño nacido sano, pero hasta ahora sólo se ha experimentado con animales y con células humanas como cigotos anómalos, según dicen los investigadores con bastante éxito. Entiendo que las investigaciones y la técnica se han desarrollado suficiente como para querer dar el siguiente paso; la cuestión aquí es que ese paso es enorme.
Otros temas







